Estequiometría
Del griego στοιχειον, (stoicheion), letra o elemento básico constitutivo y metrein: medir.
Estudia las proporciones numéricas en que reaccionan químicamente las sustancias así como las relaciones de mol, masa, energía, y volumen en las reacciones químicas.
Estequiometría es el estudio de las relaciones ponderales o de masa entre reactivos y productos en una reacción química. Cuando los químicos investigan la estequiometría de una reacción generalmente evalúan las cantidades de reactantes que se combinan para producir diferentes cantidades de productos.
La Estequiometría predice lo que debería suceder, pero no lo que sucederá en una reacción química
1.- Peso molecular
En la tabla periódica se registran las masas atómicas de todos los elementos químicos conocidos; están registrados en UMA (unidad de masa atómica). Es así como:
- El sodio tiene una MA ( masa atómica) = 22.99 UMA.
- El oxígeno tiene una MA (masa atómica)= 16.00 UMA.
Recordemos que una UMA (unidad de masa atómica)
es la doceava parte de la masa de un átomo de Carbono 12.
Como las masas atómicas de los elementos químicos se expresan en UMA, y está a su vez se refiere a la masa del carbono 12, las masas atómicas de todos los elementos son relativas; por tanto, podemos afirmar que:
La unidad de masa atómica (UMA), constituye una escala relativa
para las masas de los elementos químicos.
A partir de las masas atómicas
de los elementos podemos calcular la masa molecular (MM) de las moléculas, si
conocemos el tipo de elementos que la forman; esto permite definir.
La masa
molecular (MM) es la suma de las masa atómicas (en UMA)
de los
átomos de los elementos que constituyen una molécula
El proceso para calcular la masa
molecular consiste en:
Veamos algunos ejemplos:
En el primer ejemplo podemos observar que a partir de la fórmula molecular del compuesto se puede determinar el porcentaje de cada elemento presente.
Actividad 1.
Imprime el cuadro y determina el Peso molecular así como el porcentaje de cada elemento de los compuestos formados.
2.- El mol
La palabra "mol" se deriva de la palabra latina "moles" que significa "una masa". "Molécula" es el diminutivo de dicha palabra y significa "una masa pequeña".
Como los átomos son tan pequeños, una muestra visible de cualquier
sustancia contiene un enorme número de ellos. Por esta razón, para contar de manera
adecuada toda clase de partículas microscópicas, como átomos, moléculas, iones,
etc, los químicos han definido una unidad de materia que contiene un número conocido de partículas, el mol, se
define como:
Mol: es
la cantidad de materia que contiene el mismo
número de partículas que el número exacto de
átomos
contenidos
en 12 gramos del isótopo de 12C
Es
importante subrayar que el mol es una unidad de conteo, y que siempre contiene
el mismo número de partículas, independientemente de la sustancia que se trate.
Así pues, ¿Cuántas partículas hay en un mol?
A
lo largo de los años este número ha sido determinado experimentalmente cada vez
con mayor precisión. A este número se le conoce como: Número de Avogrado (NA)
en honor al químico italiano Amadeo Avogadro y su valor es:
NA: 6.0221367 x 1023
partículas
Con
esto en mente podemos afirmar que un mol
de cualquier cosa contiene el número de Avogadro de esa cosa.
Esta manera de expresarlo, aún siendo correcta desde el punto de vista matemático, nos impide muchas veces darnos cuenta de la inmensidad de las cantidades que manejamos y su significado, por ejemplo, si dividimos toda la Tierra en pequeñas bolas de unos 15 cm de diámetro todas ellas nos darían el número de Avogadro.
La American Chemical Society (ACS) declaró el 23 de octubre de cada año como día del mol. Ese día muchas facultades de química en el mundo amanecen de fiesta celebrando al mol. Incluso podemos ver vídeos que celebran el nacimiento del concepto más importante de la Química:
¿ Qué te parece?¡Tan importante es que hasta le cantan la mañanitas con mucho ritmo!
¡Ni hablar! Ahora realizemos algunos cálculos con la estrella del video: el mol
Como te habrás dado cuenta, para realizar cualquier cálculo con moles, se requiere deteminar primero el Peso molecular del compuesto o el peso del elemento.
Actividad 2.
Realiza los cálculos necesarios y complementa la tabla.
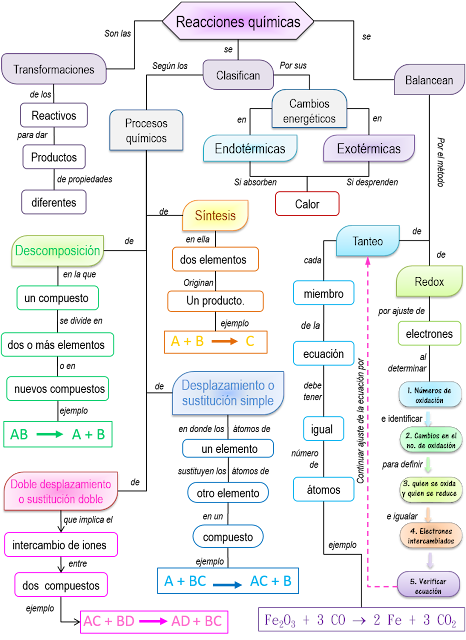
3.- Leyes estequiométricas
Las relaciones de reactivos y productos en la reacciones químicas cumplen con una serie de reglas o leyes que se denominan Leyes ponderales,las cuales relacionan cuantitativamente las sustancias involucradas en una reaccoión química. Dichas leyes son:
a) Ley de la conservación de la materia
Encontrada por el químico francés Antonio Laurent Lavoisier, señala que:
La reacción para producir òxido férrico está equilibrada porque a cada lado de la flecha existe el mismo número de átomos de hierro (Fe), oxígeno (0) e hidrógeno (H) ). Observa
2Fe + 3H2O ==> Fe2O3 + 3H2
Reactivos Productos
Átomos de Fe : 2 Átomos de Fe : 2
Átomos de 0 : 3 Átomos de 0 : 3
Átomos de H : 6 Átomos de H : 6
A los números que hemos añadido para ajustar la ecuación se les llama coeficientes estequiométricos.
b) Ley de proporciones recíprocas o de los pesos equivalentes,
Fué enunciada por el alemán J.B. Richter y dice que:
Esta Ley permitió establecer el peso de combinación o peso equivalente gramo de un elemento que es el número de gramos del mismo que se combinan con o se desplazarán con 8 g de oxígeno ó 1.008 g de hidrógeno.
c) Ley de proporciones definidas
Descubierta por el químico francés J.L. Proust y se anuncia de la siguiente manera:
De acuerdo con esta ley, dos moléculas de hidrógeno se combinarán siempre con una de oxígeno para producir 2 moléculas de agua.
2H2+ 02
--> 2 H20
d) Ley de las proporciones múltiples.
Establecida por el físico
inglés John Dalton, señala que:
Esto es, 2 partes en peso de hidrógeno se unen siempre
con 2 partes en peso de cloro para producir ácido clorhídrico.
Veamos la aplicación práctica de este principio por medio
de la producción de cloruro de sodio (sal).
Na OH + HCl ==> Na Cl + H2O
39.997 g. 36.465 g 58.447g 18.015g
Esta ley nos permite calcular la cantidad exacta de cada
sustancia que debemos combinar en cualquier ecuación.
También, de acuerdo con la ley de Lavoisier tenemos que
76.462 g de reactivos (NaOH + HCl) producen 76.462 9 de productos (NACl + H20).
Actividad 3.
Cuadro resumen: Completa el cuadro con la información que se pide











Comentarios
Publicar un comentario