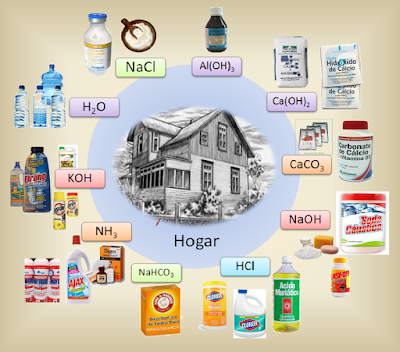
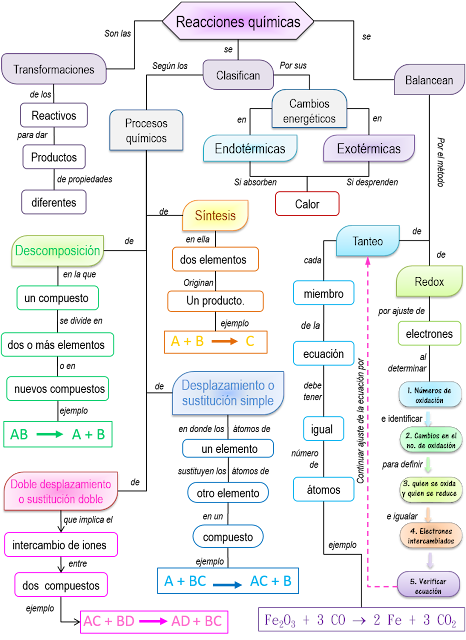
Transformaciones Químicas
Reacción química, forma de representar matemáticamente el proceso en el que una o más sustancias —los reactantes— se transforman en otras sustancias diferentes —los productos de la reacción.
Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con el hierro.
Elementos de una reacción química:
Tipos de Reacciones Químicas:
2. Reacciones de análisis o descomposición

4. Reacciones de doble sustitución:
5. Reacciones de neutralización:
Las reacciones de neutralización son generalmente exotérmicas, lo que significa que producen calor.
6. Reacciones de óxido-reducción:
Este tipo de reacciones ocurren cuando algunas sustancias transfieren sus electrones, Para que exista una reacción redox, en el sistema debe haber una especie que ceda electrones y otra especie que las acepte:
- El reductor es la especie química que tiende a ceder electrones de su estructura química al medio, quedando con carga mayor a la que tenía.
- El oxidante es la especie que tiende a captar esos electrones, quedando con carga menor a la que tenía.

- La oxidación se refiere a la pérdida de electrones por parte de una especie química.
- La reducción se presenta cuando una especie química acepta o gana los electrones transferidos.
7. Reacciones Reversibles:
Cuando los productos de una reacción pueden volver a reaccionar entre sí, para generar los reactivos iniciales. También se puede decir que se realiza en ambos sentidos.
8.Reacciones Irreversibles:
Cuando los productos permanecen estables y no dan lugar a que se formen los reactivos iniciales. Toda reacción es más o menos reversible; pero en muchos casos esta reversibilidad es tan insignificante que se prefiere considerar prácticamente irreversible.B. De acuerdo a su energía:
En toda reacción química hay emisión o absorción de energía que se manifiesta como luz y/o calor. Aquí aparece el concepto de Entalpía, entendida como la energía que se libera o absorbe. Cuando los cambios químicos van acompañados de energía, se producen las siguientes reacciones:
9. Reacción exotérmica:
10. Reacción exotérmica:
• Combustión: es una reacción química en la que un elemento combustible se combina con otro comburente (generalmente oxígeno en forma de O2 gaseoso), desprendiendo calor y produciendo un óxido; la combustión es una reacción exotérmica debido a que su descomposición en los elementos libera calor y luz. Es la combinación rápida de un material con el oxigeno, acompañada de un gran desprendimiento de energía térmica y energía luminosa.











Hola, gracias por toda eta información, no sé si me puedes aclarar dos cosas
ResponderEliminarSuponiendo los siguientes ejemplos:
A + B ----- C + D - 110kcal (sería exotérmica debido a que libera energía)
A + B ----- C + D =100kcal (sería exotérmica, apesar de que no entiendo el igual=)
A + B + Calor ------ C+D (seía endotérmica)
Si estoy equivocada me encantaría recibir tu ayuda.
Te lo agradezco.